本文关于药物临床试验法律法规,据
亚洲金融智库2021-04-19日讯:
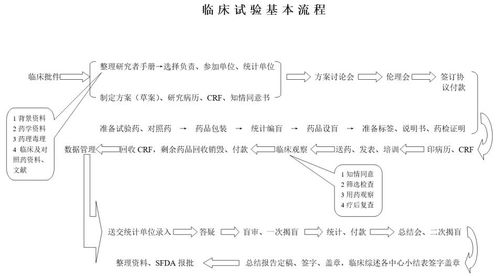
1.请问对药物的临床试验有什么规定
请问对药物的临床试验有下列规定: (1)药物的临床试验必须经过国家食品药品监督管理局批准, 必须执行《药物临床试验质量管理规范》。
药品监督管理部门应当对批准的临床试验进行监督检査。 (2)申请新药注册应当进行临床试验。
仿制药申请和补充申请,根据本办法附件规定进行临床试验。 药物临床试验分为1、2、3、4期,还包括生物等效性试验。
1期临床试验:初步的临床药理学及人体安全性评价试验。 观察人体对于新药的耐受程度和药代动力学,为制定给药方案提供依据。
2期临床试验:治疗作用初步评价阶段。其目的是初步评价 药物对目标适应证患者的治疗作用和安全性,也包括为3期临床 试验研究设计和给药剂量方案的确定提供依据。
此阶段的研究设计可以根据具体的研究目的,采用多种形式,包括随机盲法对照临床试验。 3期临床试验:治疗作用确证阶段。
其目的是进一步验证药物对目标适应证患者的治疗作用和安全性,评价利益与风险关系,最终为药物注册申请的审查提供充分的依据。试验一般应为具有 足够样本量的随机盲法对照试验。
4期临床试验:新药上市后应用研究阶段。其目的是考察在广泛使用条件下的药物的疗效和不良反应,评价在普通或特殊人群中使用的利益与风险关系,以及改进给药剂量等。
生物等效性试验是指用生物利用度研究的方法,以药代动力 学参数为指标,比较同一种药物的相同或不同剂型的制剂,在相同的试验条件下,其活性成分吸收程度和速度有无统计学差异的人体试验。
专题推荐:

